torsdag 11 december 2008
Även i dag tränade vi till det nationella no-proven
onsdag 10 december 2008
Mera träning inför nationella no-proven och TIMSS
De TIMSS-uppgifter som offentliggjorts använde jag som övningsuppgifter inför nationella no-proven. I dag tog vi itu med biologifrågorna. Det gick ganska bra. Den fråga som orsakade mest huvudbry för eleverna var: Vad är det för skillnad mellan en växt- och en djurcell? Ja, det var länge sedan vi läste om det, i början av sjuan. Vår allra första no-kurs handlade bland annat om det.
Vad kan man svara då?
- Växtceller har cellvägg av cellulosa i stället för cellmembran som djurceller har.
- Växtceller har vattenfyllda vakuoler med ett ganska högt tryck. När trycket minskar sloknar växten.
- Växtceller har kloroplaster som innehåller klorofyll. Klorofyll är det gröna färgämne som omvandlar strålningen från solen till kemisk energi. Det har inte djurceller.
Om du vill ladda ned provet som pdf, finns det här.
tisdag 9 december 2008
Planering av vårterminen 2009
måndag 8 december 2008
Astronaut tappade verktygsväska
Linda Skugge länkar till nobloggarna
fredag 5 december 2008
Provet idag
onsdag 3 december 2008
måndag 1 december 2008
Studieteknik
Vill du ha fler studietekniktips kan du titta här:
http://sites.google.com/site/asasno/Home/lyckas-med-dina-studier/Studieteknik
Det är inget nytt, det är mina gamla vanliga tips, men det kan vara bra att fräscha upp minnet lite.
Korta kommentarer till målbeskrivningen, G-delen
G-delen
- Arvets och miljöns betydelse för utvecklingen av våra egenskaper.
Jag tar ett exempel om längd. En person kan ha anlag för att bli lång i sin arvsmassa, men om personen inte får tillräckligt med mat eller utsätts för kraftig stress under sin uppväxt kommer han/hon inte att bli så lång som han/hon hade kunnat bli.
Ett exempel från växtriket kan ju inte skada. Om vi har två genetiskt identiska tallar och låter den ena slå rot inne i en skog och den andra på en blåsig strand, kommer de inte att se likadana ut, trots att deras gener är identiska. Tallen som växt i skogen kommer att vara rak, smal och lång, medan tallen som växt på stranden blir sned, knubbig och kort på grund av den hårda miljön.
- Exempel på egenskaper som helt bestäms av arvet och egenskaper som bestäms av arv och miljö.
Egenskaper som påverkas av arvet och miljön: temprament, solbränna, kroppsstorlek, intelligens, och hur fort man kan springa.
- Kromosomernas uppbyggnad
- En gen är en del av DNA-molekylen.

- Dominanta och recessiva anlag
Recessiva anlag "förlorar" mot dominanta. För att ett recessivt anlag ska kunna slå igenom krävs det att det finns i dubbel uppsättning. Det krävs att man har två anlag för blå ögon för att man ska få blå ögon. Recessiva anlag skrivs med liten bokstav.
- Hur könet ärvs
XX = ficka
XY = pojke
Äggen innehåller alltid en X-kromosom (kvinnor har ingen Y-kromosom). Hälften av spermierna kommer att innehålla X-kromosomer och hälften Y-kromosomer. Om en spermie med en X-kromosom vinner simtävlingen får det befruktade ägget uppsättningen XX = flicka. Om en spermie med en Y-kromosom vinner simtävlingen får det befruktade ägget uppsättningen XY = pojke.
- Mutation är en förändring i arvsmassan
Om mutationen uppstår i en vanlig kroppscell kan den inte ärvas vidare, men den kan ändå orsaka sjukdom, till exempel cancer.
- Mutationer kan orsaka cancer
Satsar du på VG eller MVG?
Genteknik, gentester och genterapi
- Genteknik
- Gentester
- Genterapi
Genteknik
Genteknik innebär att man klipper och klistrar i DNA-molekyler. Nuförtiden kan man identifiera (=hitta) gener i DNA-molekylen, klippa ut dem och klista ihop dem med DNA från en annan organism.
Exempel:
Det finns personer vars hypofys inte kan tillverka tillräckligt med tillväxthormon. Det leder till att dessa personer blir väldigt korta. Man kan hjäpa dem genom att ge dem piller med tillväxthormon. Tidigare var man tvungen att framställa tillväxthormon från döda människors hypofyser. Nu förtiden kan man i stället klippa ut "receptet" på tillväxthormon från en DNA-molekyl som kommer från en människa och sedan klistra in "receptet" i en bakteries DNA-molekyl. Bakterien kommer då att kunna tillverka tillväxthormon. På så sätt kan man framställa tillväxthormon till dem som behöver det. Man kan även tillverka insulin på motsvarande sätt.
Gentester
När man gör en gentest undersöker man en persons gener. Då kan man få reda på om personen bär på några allvarliga genetiska sjukdomar. Man kan även göra gentester på foster. Då suger man ut lite fostervatten och undersöker om det finns några sjukdomsanlag.
Genterapi
Genterapi innebär att man för över friska gener till en sjuk person. Det är nästan som en organtransplantation, men i stället för att sätta in ett nytt organ sätter man in nya gener.
Gener & sånt

Jag berättade om vad jag läst i den här eminenta boken, Gener & sånt.
Ett avsnitt handlar om djur som medicinfabriker. I Finland finns det kor som tillverkar medcicin till blödarsjuka. Blödarsjuka saknar ett protein som ser till att blodet koagulerar (=stelnar) om man fått ett sår. Hur kan korna tillverka medicin? Jo, först har man tagit ut genen som bär på receptet till det protein som blödarsjuka saknar från en människa. Sedan har man sprutat in genen i några befruktade koägg. När dessa befruktade ägg utvecklats till kor kommer de att kunna tillverka proteinet som blödarsjuka saknar. Korna kissar ut proteinet. Praktiskt, eller hur? Urinen renas och man kan sedan sälja medicinen. Det räcker med några få kor för att göra medicin till alla blödarsjuka i hela världen. Det finns fler exempel på djur som används på det här sättet.
Jag berättade också om David Vetter, the bubble baby. Han föddes med en ärftlig sjukdom, SCID (severe combined immunodeficiency) som gör att man blir extremt infektionskänslig. Det beror ett fel i den gen som innehåller receptet på det protein som hjälper de vita blodkropparna att bekämpa sjukdomar. För att förhindra att David Vetter skulle komma i kontakt med olika bakterier och virus levde han i olika plastbubblor mellan 1971 och 1984. Läs mer om David Vetter på nätet, till exempel på Wikipedia. Man har behandlat barn med SCID med genterapi. Då tar man ut celler från barnens bemärg, och sätter in en gen med rätt proteinrecept i dem. Sedan placerar man in cellerna i barnets benmärg.Där börjar de att föröka sig och producera riktiga vita blodkoppar.
Vi diskuterade problem och möjligheter med fosterdiagnostik och gentester. I Sverige får föräldrarna avgöra om de vill låta barnet födas trots en genetisk skada eller om de vill göra abort. Hur ska vi välja? Vem har rätt att födas? Handikapporganisationer protesterar ibland mot fosterdiagnostiken. De är oroliga för att många foster med funktionshinder ska väljas bort och att de som föds med funktionshinder känner att de inte har rätt att leva. Det är inga lätta frågor att ta ställning till.
tisdag 25 november 2008
Målbeskrivningen, Dominanta och recessiva anlag, Kromosomantal och Könskromosombundet arv
Målbeskrivningen fick ni på papper i dag. Jag har även mejlat ut den till er och era föräldrar. Om du ändå inte har någon målbeskrivning finns den att hämta på webbsidan som heter Åsas no. länk finns i spalten här intill.
Dominanta och recessiva anlag
Vi pratade lite om vilka anlag som är dominanta och vilka som är recessiva. Det är inget man ska lära sig utantill, men det kan vara kul att fundera lite på det.
Exempel på dominanta anlag:
- Lockigt hår
- Fylliga läppar
- Grop i hakan
- Skrattgropar
- Fräknar
- Fria öronsnibbar
- Vida näsborrar
Kromosomantal hos några olika växter och djur
Könskromosombundet arv Anlaget för röd-grön färgblindhet orsakas av ett recessivt anlag som kan finnas i X-kromosomen men inte i Y-kromosomen. En kvinna kan bära på ett anlag för färgblindhet i sin ena X-kromosom utan att vara färgblind. Det beror på att hon har anlag för normalt färgseende i den andra X-kromosomen och det räcker. En man har ju bara en enda X-kromosom, och om den har anlaget för färgblindhet så blir personen färgblind eftersom det inte finns någon mer X-kromosom som kan kompensera för felet.
Vi fyllde i några korsningsscheman och undersökte hur arvsgången blir i sådana här fall. Intressant, eller hur?
Albinism
Vi pratade om albinism som är en sjukdom som ärvs recessivt. Albinism medför att man har brist på pigment i ögon, hår och hud. 1/70 bär på anlaget. Hur stor är chansen/risken att två anlagsbärare träffas och får barn? Hur stor är Chansen/risken att barnen ärver sjukdomen? Ja, det funderade vi lite på. Vi återkommer till detta.

Minigrupparbeten Som avslutning gjorde vi väldigt små grupparbeten om olika saker som har med genetik att göra.
söndag 23 november 2008
Gammalt genetikprov
Korsord, Hur anlag ärvs och Korsningsscheman
Vi inledde lektionen med en lätt (nåja) uppvärmning för att ställa in hjärnan i genetikläge:

Hur anlag ärvs
Jag berättade om hur anlag ärvs och vi antecknade några nya ord:
- Homozygot = Två likadana anlag
- Heterozygot = Två olika anlag
- Dominant anlag = Anlag som slår igenom,"vinner".Till exempel anlaget för brunögonfärg.
- Recessivt anlag = Anlag som inte slår igenom, det anlag som "förlorar". Till exempel anlag för blå ögonfärg.
Korsningsscheman
De flesta gillar att göra korsningsscheman, jag också. Jag gick igenom några klassiska exempel som visar hur ögonfärg ärvs när det gäller blå och bruna ögon. Ni fick även tillfälle att fundera lite på egen hand.

Tyvärr syns det inte vad det står i hjälprutan här ovanför. Jag skriver det här också:
- Vi har dubbla arvsanlag. Ena anlaget har vi fått från vår mamma och det andra från vår pappa.
- En person som har fått två likadana anlag kallas homozygot. (Till exempel anlag för bruna ögon från mamma och anlag för bruna ögon från pappa.)
- En person med två olika anlag kallas homozygot. (Till exempel anlag för bruna ögon från mamma och anlag för blå ögon från pappa.)
- Ett dominant anlag skrivs med stor bokstav.
- Ett recessivt anlag skrivs med liten bokstav.
B = Anlag för bruna ögon
b = Anlag för blå ögon
Anlagskombinationen Bb ger bruna ögon eftersom brunt dominerar över blått. Anlagskombinationen BB ger givetvis bruna ögon.
Anlagskombinationen bb ger blå ögon.
Exempel 1
Albert är brunögd och har anlagen Bb. Det betyder att han har ett anlag för bruna ögon och ett anlag för blå ögon.Hälften av hans spermier kommer att innehålla anlag för bruna ögon och hälften av spermierna kommer att innehålla anlag för blå ögon.
Beata är också brunögd och har anlagen Bb. Det betyder att hon har har ett anlag för bruna ögon och ett anlag för blå ögon. Hälften av hennes ägg kommer att innehålla anlag för bruna ögon och hälften av äggen kommer att innehålla anlag för blå ögon.
I den lodräta raden(nedåt) skiver vi vilka ögonfärgsanlag spermierna kan ha. I den vågräta raden skriver vi vilka ögonfärgsanlag äggen kan ha. I rutorna ser vi hur dessa anlag kan kombineras.

- Om spermien med anlaget B befruktar ägget som har anlaget B får barnet anlagskombinationen BB och därmed bruna ögon.
- Om spermien med anlagetb befruktar ägget som har anlaget B får barnet anlagskombinationen Bb och därmed bruna ögon.
- Om spermien med anlaget b befruktar ägget som har anlaget b får barnet anlagskombinationen bb och därmed blå ögon.
Exempel 2
Albert är brunögd och har anlagen BB. Det betyder att han har två anlag för bruna ögon. Han kan därför bara tillverka spermier med anlag för bruna ögon, B.
Beata är blåögd och har anlagen bb. Det betyder att hon har två anlag för blå ögon. Hennes ägg innehåller därför bara anlag för blå ögon.

I korsningsschemat kan vi se att 100% av barnen får bruna ögon. Men eftersom alla har anlag för blå ögon finns det en möjlighet för dem att få blåögda barn i framtiden.
Proteintillverkning i cellerna
Generna styr allt som händer i cellen. De gör att cellen kan växa, arbeta och dela sig. Cellerna består huvudsakligen av proteiner. Proteinerna tillverkas i ribosomerna utifrån en receptkopia som DNA sänder ut från cellkärnan. I ribosomerna kopplas aminosyror ihop till proteiner.
Vi tittade på den här bilden på overhead och skrev bildtext till den.
onsdag 19 november 2008
DNA kopierar sig själv och Mitos och meios
Först repeterade vi:

Och sedan funderade vi lite:

Var på listan ska man klämma in DNA-molekylen?
DNA kopierar sig själv
Cellerna i kroppen lever och dör. De celler som dör måste ersättas med nya. DNA:t måste finnas med i de nya cellerna. Så här går det till när DNA-molekylen kopierar sig själv innan en cell delar sig i två:

DNA-molekylen delar upp sig som ett blixtlås, i två enkelsträngar. Fria byggstenar plockas in och binds till de två enkelsträngarna. Stegpinnarna byggs upp av kvävebaser. Det finns fyra olika kvävebaser, A, T, C och G. A sitter alltid ihop med T och C sitter alltid ihop med G.
Vanlig celldelning (mitos) och reduktionsdelning (meios)
Vid vanlig celldelning kopierar DNA sig själv och sedan delar sig cellen i två likadana celler.
Före celldelningen: Till exempel en vanlig muskelcell med 46 kromosomer
Efter celldelningen: Två muskelceller med 46 kromosomer.
Reduktionsdelning sker när ägg och spermier ska tillverkas. En cell med 46 kromosomer delar sig och två ägg med 23 kromosomer var bildas. Samma sak händer när spermier bildas. En cell med 46 kromosomer delar sig och och två spermier med 23 kromosomer var bildas.
Ägg och spermier har alltså 23 kromosomer var. När de träffas, vid befruktningen, blir antalet kromosomer: 23+23=46 som det ska vara hos en människa.
tisdag 18 november 2008
torsdag 13 november 2008
Introduktion, Arv och miljö och Grundläggande begrepp
Vad är genetik ?
Från Wikipedia:
Genetik, ärftlighetslära, är en vetenskap inom biologin som studerar hur egenskaper nedärvs, hur arvsmassan är uppbyggd och fungerar, hur förändringar av generna (arvsanlagen) uppstår, samt den biologiska variationen.
Det låter lite torrt kanske, men jag lovar, det är det inte. (Som ni märkte i dag). Kursen kommer också att handla om genteknik, genetiska sjukdomar, etiska frågor och växt-och djurförädling.
Arv och miljö
I dag diskuterade vi vilka egenskaper man kan ärva från sina föräldrar och vilka egenskaper som påverkas av uppväxtmiljön. Man ärver hår- och ögonfärg men inte solbränna och vältränade muskler. Däremellan finns en stor gråzon, många egenskaper beror på både arv och miljö. Man kan ju ha medfödd talang eller fallenhet för något, till exempel att sjunga, men om man aldring för möjlighet att träna på det kommer man inte att bli så bra på att sjunga (som man hade kunnat bli med lite träning).
Grundläggande begrepp
Vi gick igenom nya begrepp och repeterade gamla:
- cell
- cellkärna
- kromosomer
- könskromosomer
- DNA-molekyl
- gen
Kromosomerna med DNA-molekylerna finns i cellkärnan i alla celler. En gen är en bit av en DNA-molekyl. DNA-molekylen liknar en spiralvriden stege med stegpinnarna AT, TA, CG och GC. Stegpinnarna bildar tillsammans "meningar" som kallas arvsanlag eller gener.
onsdag 12 november 2008
Träningsuppgifter inför nationella no-provet
1. I Paris finns det 300 meter höga Eiffeltornet. I själva verket är det inte exakt 300 meter, utan dess höjd varierar under ett år med cirka 15 cm. Förklara varför höjden ändrar sig så pass mycket.
• mer än 0 grader C (plusgrader)
• lika med 0 grader C
• mindre än 0 grader C (minusgrader)
Förklara hur du tänkte.




4. Antoinetta är på Antarktis. Där är temperaturen –33° C i dag. Hur kommer det sig att hennes kroppstemperatur ändå är 37° C?

5. Här nedanför ser du två likadana fönster. Det vänstra fönstret har träffats av en sten som någon kastat. (Tyvärr syns inte sprickorna i fönstret på den här bilden) Det andra fönstret har träffats av en tennisboll (med samma vikt och hastighet som stenen) men det blev ingen spricka i det fönstret.

Varför orsakar stenens träff en spricka i fönstret, men inte tennisbollens träff?
Träning inför nationella no-prov
Det är svårt att lägga upp träningen inför ett nationellt prov i no eftersom det aldrig tidigare givits något. Det finns inga ledtrådar att följa. Skolverkets kursplaner är ju väldigt allmänt skrivna, så där får man inte heller särskilt mycket hjälp. Jag har i alla fall sammanställt lite olika uppgifter som jag har samlat in från olika håll, *TIMSS är en källa.
Eleverna arbetade i grupper om fyra med fem olika fysikuppgifter. Uppgifterna handlade om värme, ellära och energi. Eleverna diskuterade uppgifterna tillsammans och en sekreterare skrev ned svaren. Vid lektionens slut fick grupperna berätta hur de löst uppgifterna och vi redde ut en och annan trasslig tanke. Det gick bra.
*TIMSS är studier av elevers kunskaper i matematik och naturkunskap som organiseras av IEA (The International Association for the Evaluation of Educational Achievement), en internationell organisation som genomför studier för att jämföra länders skolsystem.
tisdag 11 november 2008
Kemiprovet och tidig onsdagsmorgon
I morgon har vi helklass på laborationstimmen, alla börjar 8.20.
söndag 9 november 2008
Alkalimetaller igen
Varför blir reaktionen med natrium häftigare än reaktionen med litium? Varför blir reaktionen ännu häftigare med kalium? Fundera lite på det. Jag återkommer.
Ju längre bort från (den positiva) kärnan den yttersta elektronen är, desto lättare har den att sticka!
Därför reagerar natrium häftigare än litium. Ju längre ned i gruppen man kommer, desto häftigare reaktion.
Forsättning på laborationen kopparatomer kan bli kopparjoner
Cu -> Cu2+ + 2e-
Man kan också skriva det så här:
Cu - 2e- -> Cu2+
Jaha vad betyder detta?
Jo, pluspolen har underskott på elektroner och "suger åt sig" elektroner från kopparatomerna som finns i elektroderna. (Elektroderna= kopparpinnarna som är nedstoppade i u-röret)Av kopparatomerna har det bildats kopparjoner som ger lösningen blåturkos färg.
fredag 7 november 2008
Laboration: Hur kopparjoner blir kopparatomer och tvärt om
Här har vi en vattenlösning av jonföreningen kopparsulfat. I vattnet "simmar" kopparjoner, Cu2+ och sulfatjoner, SO42- omkring fritt. Den fina färgen kommer från kopparjonerna.

Först hällde varje grupp kopparsulfat i ett u-rör och satte dit två grafit (=kol) elektroder. Sedan anslöt de elektroderna till spänningskuben och ställde in spänningen på cirka 20 V, likström.
Efter några minuter såg det ut så här:

På elektroden som var kopplad till minuspolen började något orangebrunt skrofs att sätta sig.
Vad är det?
Tja, vi får fundera lite. Vad finns i den turkosblå lösningen? Jo, Cu2+ och SO42-. Vilken av dessa joner attraheras (=dras till) minuspolen? Det måste ju vara kopparjonen eftersom den är positiv och minuspolen är negativ. Motsatserna dras till varandra.
Vad händer med kopparjonerna när de kommer till minuspolen? Jo, vid minuspolen pumpas elektroner ut. Varje kopparjon tar upp två elektroner var och blir då kopparatomer. Fast koppar har bildats och det är det som ser ut som orangebrunt skrofs.
Bra!
Vi diskade ur u-rören, hämtade kopparelektroder och gjorde samma försök igen, fast nu med kaliumnitrat löst i vattnet. Kaliumnitratet har bara en biroll, det bryr vi oss inte om så mycket.

Kaliumnitrat i vattenlösning. Kaliumjoner, K+ och nitratjoner NO3- "simmar" omkring fritt i vattnet.
Vi kopplade in kopparelektroderna till spänningskuben och ställde in den på cirka 20 V.

Efter en stund kunde man se att ett till synes slemmigt stråk hade bildats i u-röret. "Slemmets" färg kändes bekant - snyggt turkosblått. Hum, vad är nu detta? Det måste vara kopparjoner! Det är ju samma färg som kopparsulfatet i förra experimentet hade. Javisst är det så.
Vad har hänt?
Hinner inte skriv mer i kväll, måste laga mat, fortsättning följer.
Målbeskrivningen
G
- 11 grundämnen. Titta på sidan 40 eller 80 i din kemibok om du inte kan de kemiska beteckningarna.
- Atomens delar; proton(+), neutron(oladad), elektron(-), skal och kärna är de delar som du ska kunna. Titta på ett arbetsblad som heter Atomen eller titta på tidigare blogginlägg.
- Atomnummer = antal protoner (i atomkärnan).
- Alla ämnen som tillhör samma period (=rad, vågrätt) i periodiska systemet har lika många elektronskal.
- Alla ämnen som tillhör samma grupp (kolumn, lodrätt) i periodiska systemet har lika många elektroner i yttersta skalet.
- En positiv jon bildas när en atom avger en eller flera elektroner. Exempel på positiva joner är Li+, Mg2+ och Al3+.
- En negativ jon bildas när en atom tar upp en eller flera elektroner. Exempel på negativa joner är Br-, Cl- och O2-.
- Två jonföreningar: NaCl Natriumklorid (vanligt salt som man har på pommes frites) och MgO Magnesiumoxid (det där vita pulvret som bildas efter att en bit magnesiumband har brunnit med skarpt sken).
- Mendelejev kan du läsa om här på bloggen i ett tidigare inlägg.
Resterande punkter utgår tyvärr eftersom vi inte hann med att gå igenom dem.
VG
- Grundämnenas kemiska beteckningar hittar du på sidan 40 och 80 i din kemibok.
- K-skalet: 2elektroner, L-skalet 8 elektroner och M-skalet resten (18).
- Masstal = Antalet protoner + neutroner (i atomkärnan)
- Se periodiska systemet
- Stryk över ordet fyra och skriv i stället tre. Se periodiska systemet.
- Se periodiska systemet.
- Se periodiska systemet.
- Ädelgasstruktur = 8 elektroner i yttersta skalet. Stabilt. (Dr A)
- Ämnena i grupp 1 har en valenselektron (valenselektron= elektron i yttersta skalet) som de gärna avger och bildar då joner med laddningen 1+. När de har avgett elektronen har de 8 elektroner i yttersta skalet. (Om det nu finns så många. Väte har ingen elektron alls kvar sedan den avgett sin enda. Litium har två elektroner kvar sedan den avgett en. Men nåja K-skalet är fullt så det är lugnt.)
- Ämnena i grupp 2 har två valenselektroner som de gärna avger och bildar då joner med laddningen 2+. När de har avgett elektronerna har de 8 elektroner i yttersta skalet. (Om det nu finns så många. Beryllium har två elektroner kvar sedan den avgett två. Men det är ingen fara, K-skalet är i alla fall fullt.)
- Ämnena i grupp 6 har 6 elektroner i yttersta skalet och de tar gärna upp två elektroner för att uppnå ädelgasstruktur. De bildar alltså joner med laddningen 2-.
- Ämnena i grupp 7 har 7 elektroner i yttersta skalet och de tar gärna upp enelektron för att uppnå ädelgasstruktur. De bildar alltså joner med laddningen 1-.
- Se häftet som jag visar upp på bilden längre ned i bloggen. Även sidan 11 passar in här.
tisdag 4 november 2008
Repetition och Formler för jonföreningar
- En del atomer tar upp elektroner när de bildar joner. Dessa joner blir negativt laddade.
- Andra atomer avger elektroner när de bildar joner. Dessa joner blir positivt laddade.
- Elektronerna strävar alltid efter att det ska finnas åtta elektroner i yttersta skalet. Ibland tas elektroner upp för att det ska bli åtta i yttersta skalet och ibland avges elektroner för att det ska bli åtta i yttersta skalet.
- Grundämnen med en, två eller tre elektroner i sitt yttersta skal bildar joner genom att avge dessa elektroner. Då bildas positiva joner.
- Grundämnen med fem, sex eller sju elektroner i yttersta skalet bildar joner genom att ta upp så många elektroner som krävs för att det ska bli åtta i yttersta skalet. Då bildas negativa joner.
Slå upp din kemibok på sidan 40 och titta.
Ämnena i grupp 1, väte, litium, natrium, kalium, osv har en elektron i yttersta skalet. Den avger de gärna och då bildas en jon med laddningen +1.
Ämnena i grupp 6, syre, svavel, selen osv har sex elektroner i yttersta skalet. De tar gärna upp två elektroner och bildar joner med laddningen 2-.
Ämnena i grupp 7, fluor, klor, brom, jod osv har sju elektroner i yttersta skalet. De tar gärna upp en elektron och bildar joner med laddningen -1.
Ämnena i grupp 8, neon, argon, krypton osv har åtta elektroner i yttersta skalet. De reagerar därför inte gärna.
Formler för salter

I ett tidigare inlägg här på bloggen har jag lagt upp en liten film som visar hur det går till när natrium reagerar med klorgas. Titta gärna på den igen. Vid reaktionen bildas ett salt, natriumklorid, NaCl. Det är vanligt hushållssalt som man har på popcornen.
Före reaktionen:
Natriumatom, Na ..........Kloratom, Cl
Natrium har en elektron i yttersta skalet. Den elektronen avger natrium gärna. När det är gjort har natrium åtta elektroner i yttersta skalet, vilket den strävar efter.
Klor har sju elektroner i yttersta skalet. Kloratomen tar gärna upp en elektron för att få åtta elektroner i yttersta skalet.
Natriumjon, Na+.......Kloridjon, Cl -
K L M .........................K L M
2 8 1 ............................2 8 7
Det roligaste sparade vi till sist:
Formler
I en jonförening skriver man alltid den positiva jonen först.
söndag 2 november 2008
I morgon är det dags igen!
onsdag 29 oktober 2008
Laboration: Joner kan vandra
Vi började med att repetera vilka ämnen/saker som leder ström. Leder en metallsked ström? Ja, det gör den så klart. Leder en plastsked ström? Neeeej! och så vidare. Det var inte svårt. När vi började fundera på hur det är med vatten blev det lite knepigare, men vi redde ut det. Helt rent vatten, som bara består av vattenmolekyler, H2O, leder inte ström. Vattenmolekylen är oladdad och kan inte leda ström. Om det finns joner i vattnet, Na+, Cl-, H+ eller någon annan jon kan man skicka ström genom lösningen. Joner är laddade, + eller -, och kan leda ström.
Förberedelser
Till den här laborationen behöver man använda spänningskub, så vi började med att smyga in i fysiksalen för att hämta några kuber. Jag berättade lite om hur man använder spänningskuben. Man kan ställa in den på växel- eller likström. Vi pratade om att likström går åt samma håll hela tilden, från + till -. Växelström ändrar däremot rikting hela tiden. I vanliga kontakter hemma finns växelström. Hur ofta ändrar den riktning? 50 gånger per sekund ändrar den riktning, 50 Hz. Vi skulle använda likström, så vi ställde in kuben på det.
Eftersom vi skulle använda kaliumpermanganat satte vi på oss skyddsrockar och skyddsglasögon. Sedan kunde vi börja med laborationen.

Kaliumpermanganat, KMnO4, ser ut så här. Det är gnistrande svartlila saltkristaller, väldigt snygga. Tyvärr kommer de inte alls till sin rätt på den här bilden. De var väldigt svårfotograferade. Kaliumpermanganat är en jonförening, K+ och MnO4 -. Kaliumjonen K+ har laddningen +1 och Permanganatjonen, MnO4- har laddningen -1 tillsammans bildar de kaliumpermanganat, som är neutralt, oladdat.
Laboration
Vi klippte en cirka 1,5 cm bred remsa av filtrerpapper, dränkte in den i saltvatten och lade den på ett urglas. Sedan anslöt vi remsan till en spänningskub med hjälp av två krokodilklämmor och två sladdar . Vi kopplade i hop remsan med spänningskuben, slog på den och vred upp spänningen till 20 V. Sedan gick jag runt till alla grupperna och lade en liten hög med kaliumpermanganat mitt på filtrerpappret. Vi väntade i fem minuter och när tiden var ute såg det ut så här:

Det lila hade flyttat på sig.
Nu kan man fundera på:
Vad är lila i kaliumpermanganat? Hur motiverar du det?
Om man tittar noga på bilden ser man att det lila har flyttat sig mot pluspolen. Vilken del av kaliumpermanganatet kan tänkas göra det?
Permanganatjonen, Mno4-!
Varför det? Jo, för den är negativt laddad och dras då mot plus.
+ -> <- -
+ <- -> +
- <- -> -
Dras inget mot minuspolen? Jovisst, kaliumjonerna, K+, dras dit men det syns inte.
Efter undanplockning och disk skrev vi en liten labrapport.
.
måndag 27 oktober 2008
Ädelgasstruktur, valenselektroner och jonföreningars formler
Först repeterade vi vad vi lärt oss på sistone, till exempel att
- Atomnumret anger antalet protoner för ett grundämne.
Att alla ämnen i samma grupp i periodiska systemet har lika många valenselektroner. Valenselektron = elektron i yttersta skalet
- Ämnena i grupp 1, alkalimetallerna har 1 valenselektron. Den lämnar de gärna ifrån sig och bildar då positiva joner. (H+, Li+, Na+, K+ osv) När de lämnat i från sig sin valenselektron får de 8 elektroner i yttersta skalet = stabil ädelgasstruktur.
- Ämnena i grupp 2, alkaliska jordartsmetallerna har två valenselektroner. Dessa lämnar de gärna ifrån sig och bildar då positiva joner. (Be2+, Mg2+, Ca2+ osv) När de lämnat i från sig sina valenselektroner får de 8 elektroner i yttersta skalet = stabil ädelgasstruktur.
- Ämnena i i grupp 6, har 6 valenselektroner. De tar gärna upp två elektroner för att få åtta elektroner i yttersta skalet = stabil ädelgasstruktur.
- Ämnena i grupp 7, halogenerna, har 7 valenselektroner. De tar gärna upp en elektron för att få åtta elektroner i yttersta skalet = stabil ädelgasstruktur.
- Ämnena i grupp 8, ädelgaserna, har 8 valenselektroner. De har en stabil ädelgasstruktur.
Sammanfattningsvis kan man säga att när atomer deltar i kemiska reaktioner, strävar de efter att bli så stabila som möjligt. Det gör de genom att antingen avge eller ta upp så många elektroner som krävs för att de ska få ädelgasstruktur.
Metaller och väte bildar positiva joner. Det beror på att de har få valenselektroner och då är det lättaste sättet att uppnå ädelgasstruktur att avge dem. Då bilas positiva joner. Icke-metallerna har däremot många valenselektroner, för dem är det lättast att ta upp elektroner och på så sätt uppnå ädelgasstruktur. Då bildas negativa joner.
Vi funderade på detta en liten stund:
Hmm, lite klurigt. Få se nu, O2-, oxidjon . Syre, O, har atomnummer 8. Det betyder att syreatomer har 8 protoner och därmed även 8 elektroner (atomer är alltid oladdade). Okej, men nu har vi en jon, O2-. Det är en syreatom som har tagit upp två elektroner, så totalt har vi 10 elektroner.
Nästa jon är Na+, natriumjon. Om vi tittar i periodiska systemet ser vi att en natriumatom har 11 protoner och därmed även 11 elektroner. Här har vi dock en natriumjon med laddningen +1. Det betyder att en natriumatom har avgett en elektron och bildat en jon, Na+. Det finns alltså bara 10 elektroner kvar.
Nu har vi kloridjon, Cl-. Kloratomer har 17 elektroner, men detta är en klorjon med laddningen 1- så den har en extra elektron. Totalt 18 elektroner.
Aluminiumjon, Al 3+. Aluminiumatomer har 13 elektroner. här har vi en aluminiumjon med laddningen 3+. Det betyder att det saknas tre elektroner. Totalt 10 elektroner.
Vi gick igenom allt detta mycket noggrant på lektionen.
Det var betydligt lättare att avgöra hur många valenselektroner olika atomer hade. Kalium, K, har en valenselektron eftersom kalium hör till grupp 1 i periodiska systemet. Litium, Li, har också 1 valenselektron eftersom även litium tillhör grupp 1. Brom, Br, har 7 valenselektroner eftersom den hör till grupp 7. Kväve, N hör till grupp 5 och har således 5 valenselektroner.
Nu fick ni träna på egen hand, vänsterspalten på detta papper pysslade ni med en stund.
För dem som blev snabbt klara fanns mer att arbeta med: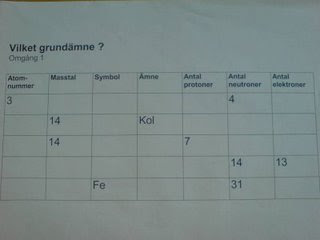
och
Det roligaste hade jag sparat till sist:
Jonföreningars formler
En jonförenings formel ska vara elektriskt neutral. Den ska innehålla det minsta antalet positiva och negativa joner som gör den neutral.
Den positiva jonen skrivs alltid först och den negativa sist.
Först har vi en kaliumjon och en kloridjon. Om de får reagera med varandra bildas jonföreningen KCl, kaliumklorid. Det orsakade inget större huvudbry eftersom en jon var negativ -1 och en jon var positiv, +1 och tillsammans blir det ju noll, neutralt.
Vi tittar på nästa ruta. här har vi en zinkjon Zn2+ och en kloridjon, Cl-. +2 och -1 blir inte noll. Hmm, vi behöver en extra negativ laddning för att det ska bli noll. Jaman då gör vi så, vi tar två negativa kloridjoner och en zinkjon med laddningen +2. då blir det noll. Så här skriver man det:
ZnCl2.
Lite längre ned i tabellen hittar vi aluminiumjonen Al3+ när den bildar en jonförening med klor blir det så här: Al3+ och Cl-, Cl-, Cl-. Det krävs 3 kloridjoner för att det ska bli neutralt. Det skrivs så här: AlCl3
Vi tar en titt på hydroxidjonen OH-. Det är en sammansatt jon. Den får man se om ett paket.
Formeln för K+ och OH- blir KOH. Inga problem.
Zn2+ och OH- då? Ja här har vi en negativ laddning för lite. Vi behöver ytterligare en OH-. Då skriver man det hela så här: Zn(OH)2 Varifrån kom parentesen? Jo det betyder att man tar två hydroxidjoner OH-. Om man skriver ZnOH2 betyder det att man tar H+ H, två väte. Tvåan hör då bara till vätet, H. När man skriver (OH)2 betyder det (OH) + (OH) att man tar två av hela paketet.
Vi lär väl ta något exempel från kolumnen med sulfatjonen SO42- också. Även SO42- är en sammansatt jon. Se den som ett paket med laddningen -2.
K+ + SO42- blir då K2SO4. Eftersom sulfatjonen har laddningen -2 behövde vi ta två K+.
Men hur blir det här då?
Al3+ och SO42-
Vi har Al3+ och SO42-
Vi behöver fler negativa laddningar.
Al3+ och SO42-
SO42-
Nu har vi 3+ och 4-. Vi behöver fler positiva laddningar.
Al3+ och SO42-
Al3+ SO42-
Nu har vi 6 positiva laddningar och 4 negativa laddningar. Vi behöver fler negativa laddningar.
Al3+ och SO42-
Al3+ SO42-
SO42-
Nu räknar vi ihop igen. 6 positiva laddningar och 6 negativa laddningar. Bra, det blir noll.
Al2(SO4)3
Om man vill lösa det hela lite snyggare kan man fundera ut minsta gemensamma nämnare, precis som när man räknar med bråk.
lördag 25 oktober 2008
fredag 24 oktober 2008
Halogenerna
Grupp 7 - Halogenerna
I den här gruppen har alla ämnen 7 elektroner i yttersta skalet. De tar gärna upp en elektron för att uppnå ädelgasstruktur, det vill säga 8 elektroner i yttersta skalet.
Halogenerna är väldigt reaktiva. De reagerar gärna med metaller och då bildas salt. Ordet halogen betyder just saltbildare.
Flour F, klor Cl, brom Br och jod I är de mest kända ämnena i halogengruppen.
Filmen här nedanför visar när metallen natrium reagerar med klorgas och vanligt koksalt bildas.
Natrium reagerar med klor
2Na + Cl2 + -> 2NaCl
Vid reaktionen flyttas en elektron från natriumatomen till kloratomen. Natriumatomen blir då en natriumjon Na+ och kloratomen blir en kloridjon Cl-. Två joner med stabil ädelgasstruktur har bildats. De har olika laddning och binds hårt till varandra. Vi har fått NaCl, vanligt koksalt.
Koksalt, NaCl är en jonförening. Den innehåller mindre energi än natrium och klor.
När du tittar på filmen är det bra att veta att sodium = natrium
Det är lättare att först filmen om man kan läsa textremsan samtidigt. Klicka på knappen längst ned i högra hörnet på filmfönstret så kommer textremsan fram.
torsdag 23 oktober 2008
Alkalimetaller
Grupp 1 - Alkalimetallerna
I den här gruppen har alla ämnen en elektron i yttersta skalet. Den kastar de gärna bort så fort de få en chans.
Överst i gruppen hittar vi väte, H. Väte är, som bekant ingen metall, men den har en elektron i yttersta skalet så väte platsar här ändå.
Om du inte redan tittat på filmen här nedanför - gör det nu.
Alkalimetallerna hittar vi under väte i periodiska systemet. De är mjuka metaller som man kan skära med kniv. De reagerar gärna med luftens syre och måste därför förvaras i fotogen. Litium, natrium och kalium har lägre densitet än vatten, så de flyter.
Lägger man en bit litium i vatten reagerar den med vattnet under gasutveckling. Om man tänder på gasen hör man ett "poff" och då förstår man direkt att det är vätgas. Med några droppar BTB kan man visa att lösningen blivit basisk efter reaktionen. Det betyder att det finns hydroxidjoner, OH-.
Gör man samma experiment med natrium får man samma resultat, fast reaktionen blir häftigare. Reaktionen med kalium blir ännu häftigare.
Varför blir reaktionern med natrium häfigare än reaktionen med litium? Varför blir reaktionen ännu häftigare med kalium? Fundera lite på det. Jag återkommer.
Vi kan ju ta och skriva en reaktionsformel för litiums reaktion med vatten:
Li + H2O -> Li+ + H2 + OH-
litium + vatten ->litiumjon + vätgas + hydroxidjon
(Det är väldigt irriterande att reaktionsformlerna blir så fula eftersom jag inte kan sänka ned och höja upp siffror och tecken här på bloggen. Men ni vet hur det ska se ut, eller hur?)
De andra alkalimetallerna reagerar på motsvarande sätt;
Na + H2O -> Na+ + H2 + OH-
K + H2O -> K+ + H2 + OH-
onsdag 22 oktober 2008
Lärorika och kluriga tester
Läs det här som har jag kopierat från testernas hemsida:
Detta är ett interaktivt frågeprogram i allmän kemi som testar förståelsen av vissa utvalda begrepp. Det kan användas av gymnasister eller första årets studenter som ett diagnostiskt test. Uppgifterna är ett urval från centrala prov i kemi för gymnasieskolan vilka gavs under åren 1969-1995. De har klassificerats och svårighetsgraderats samt anpassats med HTML- och Javascript för att passa detta media. Motiveringar har lagts till.
Atomen 15 frågor på atommassa, atomnummer, atomradie, elektroner, elektronskal, färg, grundämne, isotop, jon, kemiska egenskaper, kärnladdning, masstal, neutroner, nukleoner, protoner, och valenselektroner.
De här frågorna ingår inte i vår kurs:
1995nt -01
1978nt-11
1986nt-01
1983nt-04a
Periodiska systemet 8 frågor (vilka bäst löses med tillgång till det periodiska systemet) på atomnummer, elektroner, joniseringsenergi, masstal, neutroner, nukleoner, protoner och ämnenas gruppering.
.
söndag 19 oktober 2008
Atomer och joner Laboration: Jämför reaktionerna
Atomer
Atomer är alltid oladdade. Exempel: En atom med nitton protoner i kärnan har alltid nitton elektroner. (Vilken atom har nitton protoner i kärnan? Fundera lite eller titta i periodiska systemet. Ja, det stämmer, det är kalium.) 19+ och 19- tar ut varandra, det blir 0.
Joner
Joner är positivt eller negativt laddade.
Positiva joner
Exempel:
- En väteatom, H, består av en proton och en elektron. Om elektronen ger sig av blir protonen ensam kvar. En vätejon har bildats. Den betecknas H+. (plustecknet ska sitta lite högre upp men jag kan inte ordna det här på bloggen.)
- En magnesiumatom, Mg, har tolv protoner i kärnan och tolv elektroner som kretsar runt den. När tillfälle ges avger magnesium två elektroner och en magnesiumjon bildas. Men hur ska vi beteckna den då? Eftersom magnesiumatomen har blivit av med två negativa laddningar har vi 10- och 12+ nu. Det betyder att vi har ett överskott på två positiva laddningar, alltså skriver vi Mg2+ (tvåan och plustecknet skasitta högre upp egentligen)
Negativa joner
Exempel:
- En kloratom, Cl, kan ta upp en elektron. Då får vi en kloridjon, Cl- (minustecknet ska sitta högre upp). Från början var kloratomen neutral, 17+ och 17-, men när en negativ laddning tillkom blev de negativa laddningarna en fler än de positiva och kloridjonen Cl- bildades.
- En syreatom kan ta upp två elektroner. Då blir den en oxidjon, 02-(behöver jag tillägga att tvåan och minustecknet ska sitta högre upp?)
Laboration: Jämför reaktionerna
MIX 3 sidan 43, längst ned.
Magnesium och kalcium tillhör samma grundämnesfamilj i det periodiska systemet. I det här exemplet ska vi jämföra deras reaktion med vatten.
Först måste man sätta på sig skyddsrock och skyddsglasögon. Sedan kan man hämta kemikalier och matriel.

Skyddsglasögon
Ta fram:
* Två provrör
* Provrörsställ
* Vatten
* Tång
* Magnesiumbit
* Kalciumbitar Ta inte i kalcium med händerna. Använd tång.
* BTB BTB är en indikator som visar pH-värde. Om BTB är grönt betyder det att lösningen är neutral, pH 7, om BTB är blått betyder det att lösningen är Basisk pH > 7 och om BTB är gult är lösningen sur pH<7 Vi hällde i vatten till en centimeters höjd i provrören. Därefter tillsatte vi i ett par droppar BTB. I det ena provröret lade vi ned magnesiumbiten och i det andra lade vi ned kalciumbitarna. Efter en liten stund började det att fräsa och bubbla i provröret med kalcium. Lösningen fick blå färg.

Kalcium reagerar med vatten
Provröret blev varmt och kalciumet löstes upp. I röret med magnesiumbiten hände ingenting förutom att lösningen fick blå färg. Därför stoppade vi ned det i ett varmt vattenbad.

Magnesuim och vatten i ett provrör i varmvattenbad.
Medan vi väntade på att något skulle hända med magnesiumet gick vi bort till dragskåpet. Där hade jag lite kalcium och vatten i ett provrör som vi tittade närmare på. Vilken gas är det som bubblar upp? Hmm.. Olika förslag fördes fram. Om vi skulle försöka att tända på gasen? Får vi någon ledtråd då? Tja, kanske det. Jag höll tummen för provrörets mynning för att samla upp lite gas, sedan tände jag på gasen med en tändsticka. Poff! lät det när gasen antändes. Jaha, det var vätegas som bubblade upp. Bra, då vet vi det. Det är alltid kul med vätgas, så jag tände på den några gånger till.
Vi gick tillbaka till magnesiumet, men inget hade hänt. Vattenbadet var för kallt. Det gjorde inget, jag kan göra om det nästa vecka eller så.
Efter diskning och undanplockning var det dags att skriva en labbrapport. Jag skriver inte hela här eftersom det skulle bli tjatigt. Jag har ju redan förklarat hur experimentet gick till här ovanför men reaktionsformeln och förklaringen till vad som hände i provröret med kalciumet kommer här:
Reaktionsformel:
Ca + H2O -----> H2 + Ca2+ + OH-
valcium + vatten -----> vätgas + kalciumjon + hydroxidjon
Kalcium reagerar med vatten under vätgasutveckling. Kalcium avger två elektroner och kalciumjoner bildas. Hur vet vi att hydroxidjoner bildas? Jo, BTB blev blått. Det betyder att lösningen är basisk och i basiska lösningar finns OH-.
Om man är på hugget och vill balansera reaktionsformeln blir det så här:
Ca + 2H2O -----> H2 + Ca2+ + 2OH-
Antalet atomer av de varje sort är lika på vänster och höger sida om pilen. Ingenting har försvunnit.
Vi återkommer till det här experimentet.
fredag 17 oktober 2008
Mendelejev och elektronskal
Mendelejev - periodiska systemets konstruktör

Dimitrij Mendelejev växte upp med sin ensamstående mamma i Sibirien, Ryssland i mitten av 1800-talet.. Hans mamma, som drev en tvålfabrik, såg till att sonen fick studera kemi. Det innebar många och långa tågresor för Dimitrij. På tåget lade Dimitrij ofta patiens för att få tiden att gå. Kemistudierna flöt på bra och Dimitrij var nöjd med livet. Han fick möjlighet att delta i en stor kemikonferens i Tyskland där många nyupptäckta grundämnen presenterades. Efter konferensen fick han en snilleblixt- han kom på att han skulle skriva ned alla kända grundämnen på små lappar som han sedan kunde lägga ut på ett bord, gruppera och flytta runt som han ville. Nästan som patiens. Dimitrij förstod att han kunde sortera ämnena efter deras egenskaper, och efter hand växte det periodiska systemet fram. Här och där fanns hål i Dimitrijs periodiska system. Dimitrij kunde förutsäga vikt och vilken sorts ämnen som fattades. Han behövde inte vänta länge förrän kemister började rapportera att de hittat ämnena som skulle fylla tomrummen.
Atomnummer, masstal och elektroner
Hur var det nu igen? Jo, atomnumret talar om hur många protoner det finns i ett grundämne. Om atomnumret är 17 kan man leta reda på nummer 17 i periodiska systemet och då kommer man att se att det är klor, Cl som har atomnummer 17.
Masstalet då? Antalet protoner + antalet neutroner är masstalet.
Eftersom en atom är oladdad finns det alltid lika många elektroner(-) som protoner(+). Klor har alltå 17 elektroner.
Övningsblad för att befästa kunskaperna:

Tyvärr går det inte att läsa frågorna från det här fotot. Men här är några exempel:
- Ett grundämnes atomer har 8 protoner. Vilket är grundämnet?
- En atom med 61 neutroner har masstalet 108. Vilket är grundämnet?
- Vilket masstal har en kolatom med 8 neutroner?
- Vilket masstal har den vanligaste kväveisotopen? Den har lika många protoner som neutroner.
- Hur betecknas en aluminiumatom som har 14 neutroner?
De som var snaba fick sedan hugga in på detta roliga blad:
För att kunna göra klart hela bladet behövdes lite nya kunskaper om elektronskal. Jag gick igenom det på tavlan.
Elektronskal
Elektronerna i atomerna är ordnade i skal. Det innersta skalet rymmer bara två elektroner, det kallas K-skalet. Nästa skal rymmer 8 elektroner och kallas L-skalet. Nu är det inte svårt att lista ut att nästa skal heter M-salet. Det rymmer 18 elektroner.
Väte, H, har atomnummer 1 och därmed 1 proton i kärnan. Det betyder även att väte har en elektron. Den finns i K-skalet.
Helium, He, har atomnummer 2 och därmed två protoner i kärnan. Helium har två elektroner som får plats i K-skalet.
Litium, Li, har atomnummer 3, alltså 3 protoner och 3 elektroner. Två av elektronerna finns i K-skalet, den tredje får inte plats där. Den finns i L-skalet.
Natrium, Na, har atomnummer 11, alltså 11 protoner och 11 elektroner. Elektronerna fördelar sig så här; två i K-skalet, åtta i L-skalet och en i M-skalet. Titta på bilden här nedanför.

Elektronkonfiguration för natrium 2,8,1
Som du ser är det är inte så svårt. Man fyller bara på skalen innifrån och ut.
Ännu mer träning

Vi blev inte helt klara med dessa övningar.














