Först repeterade vi vad vi lärt oss på sistone, till exempel att
- Atomnumret anger antalet protoner för ett grundämne.
Att alla ämnen i samma grupp i periodiska systemet har lika många valenselektroner. Valenselektron = elektron i yttersta skalet
- Ämnena i grupp 1, alkalimetallerna har 1 valenselektron. Den lämnar de gärna ifrån sig och bildar då positiva joner. (H+, Li+, Na+, K+ osv) När de lämnat i från sig sin valenselektron får de 8 elektroner i yttersta skalet = stabil ädelgasstruktur.
- Ämnena i grupp 2, alkaliska jordartsmetallerna har två valenselektroner. Dessa lämnar de gärna ifrån sig och bildar då positiva joner. (Be2+, Mg2+, Ca2+ osv) När de lämnat i från sig sina valenselektroner får de 8 elektroner i yttersta skalet = stabil ädelgasstruktur.
- Ämnena i i grupp 6, har 6 valenselektroner. De tar gärna upp två elektroner för att få åtta elektroner i yttersta skalet = stabil ädelgasstruktur.
- Ämnena i grupp 7, halogenerna, har 7 valenselektroner. De tar gärna upp en elektron för att få åtta elektroner i yttersta skalet = stabil ädelgasstruktur.
- Ämnena i grupp 8, ädelgaserna, har 8 valenselektroner. De har en stabil ädelgasstruktur.
Sammanfattningsvis kan man säga att när atomer deltar i kemiska reaktioner, strävar de efter att bli så stabila som möjligt. Det gör de genom att antingen avge eller ta upp så många elektroner som krävs för att de ska få ädelgasstruktur.
Metaller och väte bildar positiva joner. Det beror på att de har få valenselektroner och då är det lättaste sättet att uppnå ädelgasstruktur att avge dem. Då bilas positiva joner. Icke-metallerna har däremot många valenselektroner, för dem är det lättast att ta upp elektroner och på så sätt uppnå ädelgasstruktur. Då bildas negativa joner.
Vi funderade på detta en liten stund:
Hmm, lite klurigt. Få se nu, O2-, oxidjon . Syre, O, har atomnummer 8. Det betyder att syreatomer har 8 protoner och därmed även 8 elektroner (atomer är alltid oladdade). Okej, men nu har vi en jon, O2-. Det är en syreatom som har tagit upp två elektroner, så totalt har vi 10 elektroner.
Nästa jon är Na+, natriumjon. Om vi tittar i periodiska systemet ser vi att en natriumatom har 11 protoner och därmed även 11 elektroner. Här har vi dock en natriumjon med laddningen +1. Det betyder att en natriumatom har avgett en elektron och bildat en jon, Na+. Det finns alltså bara 10 elektroner kvar.
Nu har vi kloridjon, Cl-. Kloratomer har 17 elektroner, men detta är en klorjon med laddningen 1- så den har en extra elektron. Totalt 18 elektroner.
Aluminiumjon, Al 3+. Aluminiumatomer har 13 elektroner. här har vi en aluminiumjon med laddningen 3+. Det betyder att det saknas tre elektroner. Totalt 10 elektroner.
Vi gick igenom allt detta mycket noggrant på lektionen.
Det var betydligt lättare att avgöra hur många valenselektroner olika atomer hade. Kalium, K, har en valenselektron eftersom kalium hör till grupp 1 i periodiska systemet. Litium, Li, har också 1 valenselektron eftersom även litium tillhör grupp 1. Brom, Br, har 7 valenselektroner eftersom den hör till grupp 7. Kväve, N hör till grupp 5 och har således 5 valenselektroner.
Nu fick ni träna på egen hand, vänsterspalten på detta papper pysslade ni med en stund.
För dem som blev snabbt klara fanns mer att arbeta med:
och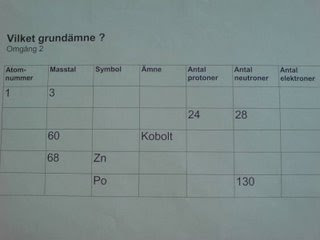
Det roligaste hade jag sparat till sist:
Jonföreningars formler
En jonförenings formel ska vara elektriskt neutral. Den ska innehålla det minsta antalet positiva och negativa joner som gör den neutral.
Den positiva jonen skrivs alltid först och den negativa sist.
Först har vi en kaliumjon och en kloridjon. Om de får reagera med varandra bildas jonföreningen KCl, kaliumklorid. Det orsakade inget större huvudbry eftersom en jon var negativ -1 och en jon var positiv, +1 och tillsammans blir det ju noll, neutralt.
Vi tittar på nästa ruta. här har vi en zinkjon Zn2+ och en kloridjon, Cl-. +2 och -1 blir inte noll. Hmm, vi behöver en extra negativ laddning för att det ska bli noll. Jaman då gör vi så, vi tar två negativa kloridjoner och en zinkjon med laddningen +2. då blir det noll. Så här skriver man det:
ZnCl2.
Lite längre ned i tabellen hittar vi aluminiumjonen Al3+ när den bildar en jonförening med klor blir det så här: Al3+ och Cl-, Cl-, Cl-. Det krävs 3 kloridjoner för att det ska bli neutralt. Det skrivs så här: AlCl3
Vi tar en titt på hydroxidjonen OH-. Det är en sammansatt jon. Den får man se om ett paket.
Formeln för K+ och OH- blir KOH. Inga problem.
Zn2+ och OH- då? Ja här har vi en negativ laddning för lite. Vi behöver ytterligare en OH-. Då skriver man det hela så här: Zn(OH)2 Varifrån kom parentesen? Jo det betyder att man tar två hydroxidjoner OH-. Om man skriver ZnOH2 betyder det att man tar H+ H, två väte. Tvåan hör då bara till vätet, H. När man skriver (OH)2 betyder det (OH) + (OH) att man tar två av hela paketet.
Vi lär väl ta något exempel från kolumnen med sulfatjonen SO42- också. Även SO42- är en sammansatt jon. Se den som ett paket med laddningen -2.
K+ + SO42- blir då K2SO4. Eftersom sulfatjonen har laddningen -2 behövde vi ta två K+.
Men hur blir det här då?
Al3+ och SO42-
Vi har Al3+ och SO42-
Vi behöver fler negativa laddningar.
Al3+ och SO42-
SO42-
Nu har vi 3+ och 4-. Vi behöver fler positiva laddningar.
Al3+ och SO42-
Al3+ SO42-
Nu har vi 6 positiva laddningar och 4 negativa laddningar. Vi behöver fler negativa laddningar.
Al3+ och SO42-
Al3+ SO42-
SO42-
Nu räknar vi ihop igen. 6 positiva laddningar och 6 negativa laddningar. Bra, det blir noll.
Al2(SO4)3
Om man vill lösa det hela lite snyggare kan man fundera ut minsta gemensamma nämnare, precis som när man räknar med bråk.


Inga kommentarer:
Skicka en kommentar